·
Reações de oxirredução

Exemplo:
Analisando isoladamente a transformação que ocorreu em cada um desses
elementos, temos:
- Zn0 ____ Zn2+ (perda de elétrons)
- Cu2+ ____ Cu0 (ganho de elétrons)
Nesse caso, o zinco foi oxidado, ou
seja, ele perdeu elétrons sendo chamado de agente
redutor, pois se ele perdeu elétrons, estes serão transferidos para outro
elemento.
Já o cobre foi reduzido, ou seja,
ganhou os elétrons perdidos pelo zinco. Logo, ele é chamado de agente oxidante.
Atribuição do número de oxidação (nox):
- O nox de toda substância simples é igual a zero;
- Todos os metais alcalinos da família 1A, exceto hidrogênio, possuem o nox igual a +1;
- Os metais alcalino-terrosos, referentes a família 2A (Be, Mg, Ca, Sr, Ba, Ra), possuem o nox igual a +2;
- Prata(Ag), zinco(Zn) e alumínio(Al) possuem os nox de, respectivamente, +1, +2 e +3;
- O hidrogênio, quando ligado com metal possui o nox = -1. Ex.: LiH. Já quando ligado a um ametal, o hidrogênio seu nox é igual a +1. Ex.: HBr;
- O oxigênio é possui, predominantemente, o nox igual a -2.
EXCEÇAO: Quando a substância for um peróxido, o nox do oxigênio passa a valer -1.
Obs.:
geralmente, a soma dos nox de uma substância é igual a zero.
Ex.: H+N+5O32-
Como existem 3 átomos de oxigênio, a soma total de sua carga será de -6, a qual será anulada com o +1 do hidrogênio e o +5 do nitrogênio.
Porém, em outros casos, a soma das cargas não será igual a zero.
Ex.: (Mn+7O4-2)-
Nesse caso, a soma total terá que ser igual a -1.
Regras de balanceamento de reações de oxirredução:
Exemplo:
1º passo:
∆Nox (Mn) = +5 elétrons
∆Nox (Cl) = -1 elétron
∆Nox (Cl) = -1 elétron
2º passo:
∆Nox (Mn) = +5 x 1 = +5
∆Nox (Cl) = -1 x 5 = -5
∆Nox (Cl) = -1 x 5 = -5
(mesmo número de elétrons
perdidos e recebidos)
KMnO4 + HCl
→ KCl + 2MnCl2 + 5Cl2 +
H2O
2KMnO4 +
16HCl → 2KCl
+
2MnCl2 + 5Cl2 + 8H2O
Espontaneidade de reações de oxirredução:
-Potencial padrão de redução (Eo) determina qual substância sofreu redução (maior valor de potencial) e qual sofreu redução (menor valor de potencial).
Exemplo:
Dados:
Cu2+
+ 2 e– -----> Cu° E = + 0,34 V
Zn2+
+ 2 e– -----> Zn° E = –
0,76 V
A reação será espontânea quando: a espécie que sofre
redução apresentar um Eo maior que o da espécie que sofre oxidação,
a reação é espontânea; caso contrário, não.
Nesse caso, a reação é espontânea, pois o Cu2+ é o elemento que está sofrendo redução e é o que tem maior potencial.







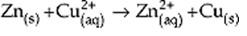



Nenhum comentário:
Postar um comentário